乳腺癌靶向药恩美曲妥珠单抗(赫赛莱、T-DM1)解读
发布日期:2021-12-08 浏览次数:
乳腺癌靶向药恩美曲妥珠单抗(赫赛莱、T-DM1)
Q1恩美曲妥珠单抗基本信息
恩美曲妥珠单抗(Kadcyla,赫赛莱)是靶向HER2的曲妥珠单抗与抑制微管聚集化疗药物美坦新(DM1)通过硫醚连接子MCC连接而成的抗体偶联物(ADC)。由罗氏和ImmunoGen共同开发,最早于2013年2月获FDA批准上市。该药物通过优先审评方式于1月21日获NMPA批准上市,是国内批准上市的首个ADC药物。

Q2恩美曲妥珠单抗上市背景
乳腺癌是全球女性最常见的癌症,其中约25%~30%乳腺癌存在HER2过表达。罗氏推出的3款重磅anti-HER2药物改变了HER2阳性乳腺癌的治疗模式。
1998年9月,罗氏推出首款HER2产品曲妥珠单抗,凭借该产品显著疗效优势,罗氏奠定了在HER2阳性乳腺癌的领先地位。
2012年6月,罗氏又推出帕妥珠单抗,与曲妥珠单抗联用,能够大幅度提高总体生存期,“双妥”组合此后逐渐成为HER2阳性乳腺癌的临床标准治疗方案。
次年,罗氏又推出恩美曲妥珠单抗,为接受过曲妥珠单抗治疗患者提供了后线用药保障,进一步巩固了自身在HER2的霸主地位。
Q3恩美曲妥珠单抗适应症
Kadcyla当前在全球获批的适应症有2项,包括:1)单药治疗接受过曲妥珠单抗和/或紫杉醇的晚期转移性HER2 乳腺癌;2)单药用于新辅助治疗(紫杉烷类联合曲妥珠单抗)后仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗。
Kadcyla在中国获批的适应症为:单药用于新辅助治疗(紫杉烷类联合曲妥珠单抗)后仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗。
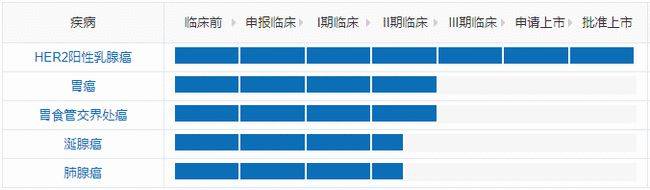
Kadcyla全球在研适应症进度
Q4恩美曲妥珠单抗治疗费用
Kadcyla是注射用的冻干粉针剂,装于西林瓶中,有100mg和160mg两个规格。临用前分别用5ml或8ml无菌注射用水复溶,配制成20mg/ml的注射用溶液,然后再根据患者体重从西林瓶中取出适量溶液,添加到250ml的输液袋中进行静脉输注。
Kadcyla两个规格的定价分别为19282元/100mg,27633元/160mg。根据Kadcyla的药品说明书推荐,每个患者的给药剂量应当按照体重以3.6mg/kg进行换算,每3周静脉注射1次,21天为一个周期(疗程),给药直至疾病进展或者不超过14个疗程。治疗期间,如果患者体重变化不超过10%,不需要调整剂量。以一个普通成人患者(60kg)为例,年治疗费用达到65万元,援助赠药后的年治疗费用大约32.8万元。
Kadcyla目前尚未进入2020年国家医保目录。
Q5恩美曲妥珠单抗循证数据及核心临床
基于国际、多中心Ⅲ期KATHERINE研究,Kadcyla改变了HER-2阳性早期乳腺癌的诊疗路径。
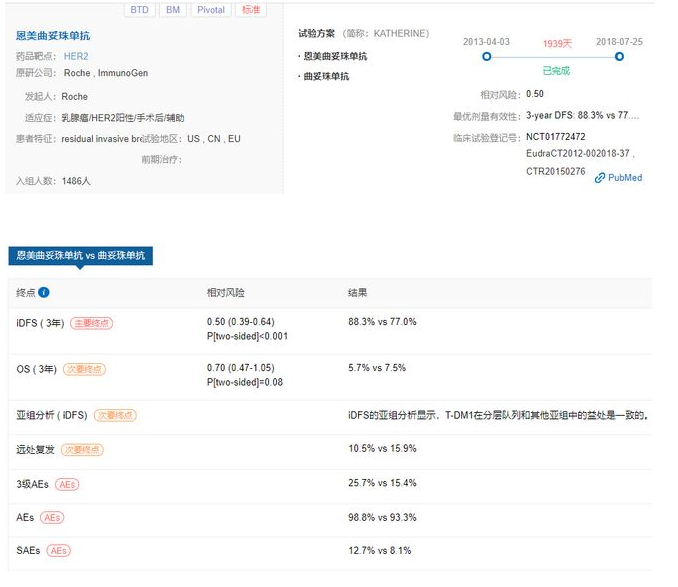
KATHERINE研究核心数据
另两项Ⅲ期研究EMILIA和TH3RESA则支持Kadcyla在HER-2阳性晚期乳腺癌中获得批准并使用。2013年起,美国食品药品监督管理局(FDA)陆续批准T-DM1用于HER-2阳性晚期乳腺癌或经辅助治疗后有残留病灶的早期乳腺癌。

EMILIA研究和TH3RESA研究
2019年一项Ⅱ期临床研究结果显示,T-DM1治疗HER-2突变肺癌的客观缓解率(ORR)高达44%。因此,NCCN指南推荐,HER-2突变的非小细胞肺癌可考虑T-DM1治疗,但T-DM1在肺癌中的适应证尚未获批。
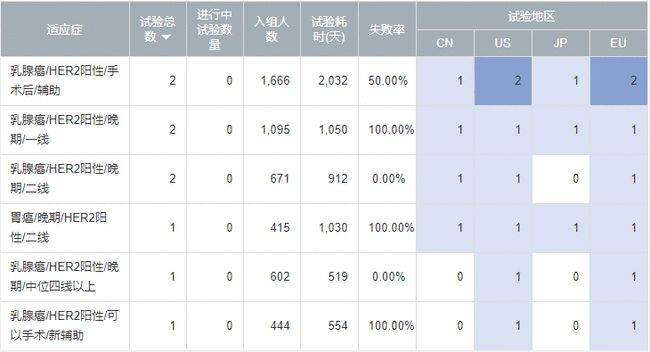
T-DM1核心临床布局
(备注:数据来源NextClinTrial数据库,仅保留以药品注册,或者以变更指南为目的的关键临床试验;排除低质量的研究者发起研究、或者药企开展的探索性质的早期临床)
Q6恩美曲妥珠单抗指南推荐
1、2020版ADC治疗恶性肿瘤临床应用专家共识
共识建议:T-DM1用于HER-2阳性乳腺癌新辅助治疗后仍有残留病灶患者的辅助治疗,与曲妥珠单抗比较,T-DM1可使患者显著获益,可大幅提高无浸润性疾病生存率。因此,公识推荐,接受抗HER-2新辅助治疗后仍有残留病灶的HER-2阳性乳腺癌患者,选择接受14个周期的T-DM1治疗。
2、NCCN临床指南:乳腺癌(2020年第6版)VS. CSCO乳腺癌诊疗指南:(2020年版)
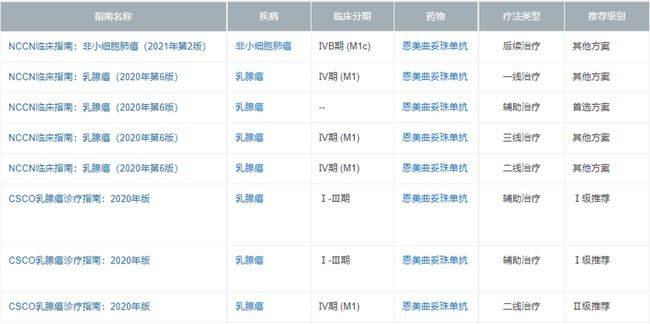
Q7恩美曲妥珠单抗合理用药要点
1. 恩美曲妥珠单抗(T-DM1)与曲妥珠单抗为不同药物,禁止在临床应用中进行替换。
2. 接受T-DM1辅助治疗的患者应符合以下要求:1)应在有资质的病理实验室通过HER2检测确认为HER2阳性(HER2阳性的定义为IHC3 和/或FISH阳性);2)完成以曲妥珠单抗(H)和紫杉类为基础的新辅助治疗方案;3)新辅助治疗后的病理评估结果未能达到病理学完全缓解。病理学完全缓解(pCR)定义为乳腺原发灶无浸润性癌且区域淋巴结阴性,即ypT0/Tis ypN0。新辅助治疗后仅残余乳腺脉管内肿瘤或仅淋巴结内残余ITC均不能诊断pCR。
3. T-DM1的推荐剂量为3.6mg/kg,采用静脉输注给药,每3周一次(21天为一个周期)。早期乳腺癌患者应接受共14个周期的治疗,除非疾病复发或出现无法控制的毒性。发生不良反应时应根据说明书及时调整剂量,剂量降低方案如下表。降低剂量后,不应再增加T-DM1剂量。
4. 临床实践中要对既往史、体格检查、心电图、超声心动图LVEF基线评估后,再开始应用T-DM1,使用期间应每3个月监测LVEF。若患者有无症状性心功能不全,检测频率应更高。
5. 建议在每次T-DM1给药之前监测血小板计数,绝大多数血小板减少可以根据说明书进行暂停或减量及停药处理后恢复。经常规升血小板治疗后效果不佳时,应尽早请血液科专科医师会诊,必要时给予针对性的检查如骨髓穿刺、血小板生成素(TPO)抗体、血小板抗体检测等,明确可能的病因后给予对症处理。
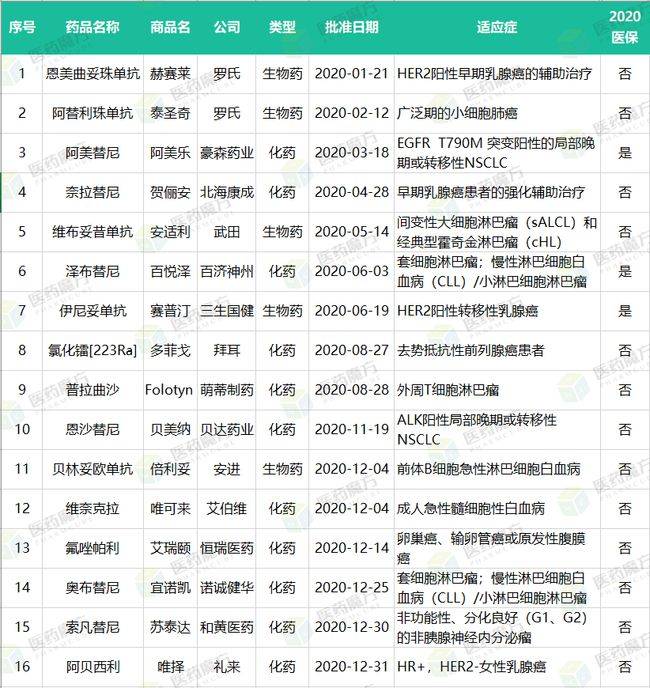
附表:2020年NMPA批准的原研抗肿瘤新药
印度肿瘤药房(India Pharmacy)是印度新德里肿瘤药房信息咨询服务平台,旨在为患者提供各类进口原研 进口仿制 最新研制等医药信息咨询 跨境医药电商直邮服务,让患者轻松获取全球最佳药品有更多选择,基本涵盖新特药 抗癌药 靶向药 丙肝 乙肝 高血压 糖尿病 痛风 等药品,欢迎咨询!官方微信 Yindu7689


