- 肿瘤专区
- 肺癌药品
- 色瑞替尼(Ceriti 瑞普替尼,REPODX, 特泊替尼,TEPODX, 克唑替尼,KESODX, 阿来替尼, AILEDX, 普拉替尼,PRASEDX, 奥希替尼(泰瑞沙 阿达格拉西布(Ad 色瑞替尼(赞可达 阿来替尼(安圣莎 阿法替尼(吉泰瑞 Augtyro(repotrectinib, 恩曲替尼(entrec 布格替尼(布加替 布格替尼(布加替 阿达格拉西布(Ad 阿那莫林(Anamorel 塞尔帕替尼 曲美替尼 普拉替尼国内上市 Gavreto普拉替尼( 普拉替尼 索托拉西布(AMG51 奥希替尼|AZD9291 Tagrix80奥希替尼 Crizocent250克唑替尼 Lumakras索托拉西布 吉非替尼Gefitinib( 达拉非尼Dabrafeni Pralsetinib 普拉替尼 Brigatinib 布加替尼 Crizotinib 克唑替尼 Selpercatinib 塞尔帕 Larotrectinib 拉罗替 Savolitinib 沃利替尼 Sotorasib 索托拉西布 Icotinib 埃克替尼 Ceritinib 色瑞替尼, Lorlatinib 劳拉替尼 Capmatinib 卡马替尼 恩曲替尼,entrec Lorbrexen劳拉替尼 Crizonix克唑替尼( 卡马替尼Capmatini 奥希替尼|AZD9291|泰 阿来替尼Alectinib 克唑替尼Crizotini 奥希替尼|AZD9291 布加替尼Briganix 布加替尼 90mg 布加替尼 180mg 吉非替尼|易瑞沙 厄洛替尼|特罗凯 阿法替尼|吉泰瑞 克唑替尼|赛可瑞 阿来替尼|Alecinix 色瑞替尼(SPEXIB) 吉非替尼|易瑞沙 阿法替尼|Afatinib 特罗凯|盐酸厄洛替 克唑替尼|赛可瑞 艾乐替尼|Alecensa 奥希替尼|AZD9291 克唑替尼Crizalk
- 肝癌药品
- 乐伐替尼(仑伐替 乐伐替尼(仑伐替 Donafenib 多纳非尼 培米替尼 培美替尼 培米替尼 培美替尼 印度仑伐替尼/乐伐 Sorafenib索拉非尼( REGONIX瑞格非尼Re 卡博替尼/卡赞替尼 乐伐替尼Lenvanix1 乐伐替尼Lenvanix4 乐伐替尼Lenvaxen1 乐伐替尼Lenvaxen4 乐伐替尼|仑伐替尼 乐伐替尼|仑伐替尼 乐伐替尼|仑伐替尼 卡博替尼 60mg 卡博替尼 20mg 卡博替尼 80mg 索拉非尼|多吉美 索拉非尼|多吉美 索拉非尼|多吉美
- 乳腺癌药品
- 艾拉司群(Elaces 卡帕塞替尼(Cap 阿贝西利(Abemac 瑞博西尼(瑞波西 瑞司美替罗(Rezdi 瑞司美替罗(Rezdi 艾拉司群(elacestr 艾拉司群(elacestr 艾拉司群(elacestr 阿贝西利(Abemac 图卡替尼,TUKADX, 阿贝西利, BESIDX, 图卡替尼(Tucati 阿培利司(Alpeli 新药|Tukysa(Tucatin 氟维司群 芙仕得 芙瑞 来曲唑 Letr 帕捷特 帕妥珠单抗 阿那曲唑,瑞宁得 恩美曲妥珠单抗 西达本胺 爱谱沙 吡咯替尼 艾瑞妮 Enhertu DS8201 100mg( 哌柏西利/帕博西 印度Abemaciclib玻玛 Enhertu(DS-8201)F Palbocent125哌柏西利 印度卡培他滨( 印度版pivikto阿博利 奈拉替尼/来那替尼 印度NATCO拉帕替尼 拉帕替尼Lapatinib 拉帕替尼(泰立沙 Ribociclib 瑞博西尼 Trodelvy 赛妥珠单抗 TUKYSA 图卡替尼 AZD8186 AZD8186 poziotinib 波齐替尼 Lapatinib 拉帕替尼 Trastuzumab 曲妥珠单 Pertuzumab 帕妥珠单 Adavosertib AZD1775 Pyrotinib 吡咯替尼 Alpelisib(阿培利司 哌柏西利|帕博西尼 哌柏西利|帕博西尼 奥拉帕尼Olaparix 来那替尼Hernix 拉帕替尼|泰立沙 哌柏西利|帕博西尼 依维莫司|飞尼妥 哌柏西利|帕博西尼
- 卵巢癌药品
- 尼拉帕尼(Nirapa 奥拉帕尼,OLADX, 奥拉帕尼,OLADX, 奥拉帕利(Olaparib 氟唑帕利 (Fluzopa 百汇泽 帕米帕利 艾瑞颐,氟唑帕利 尼拉帕尼Niranib/( Olaparib 奥拉帕利, Melphalan 马法兰,米 马法兰 爱克兰 美 尼拉帕利 尼拉帕尼 尼拉帕尼Niranib 奥拉帕利Olanib 尼拉帕利Niraparix
- 黑色素癌药品
- 考比替尼(Cobime 康奈非尼,BRATOD 维莫非尼,VEMUDX, 比美替尼-卢修斯 威罗非尼(佐博伏 达拉非尼(Tafinl Dabrafenib 达拉非尼 Mektovi(Binimetinib)贝 特瑞普利单抗 拓益 Vismodegib维莫德 Yervoy伊匹单抗(I (BRAF V600E/K突变组 司美替尼Koselugo( 威罗菲尼(Zelbor Cotellic土耳其Cobi 替莫唑胺Temonix 曲美替尼Trametini 替莫唑胺GLIOZ 替莫唑胺|蒂清 达拉非尼Dabrafeni
- 肝病专区
- 肺癌专区
- 肺癌药品
- 兰泽替尼片(Luc 达拉非尼,DABRAD 卡马替尼,CAMPAM 索托拉西布,SOT 劳拉替尼,LORLAD 曲美替尼,TRAMED 莫博替尼, MOBODX, 奥西替尼, OYSIEND 卡博替尼,CABODX, 卡博替尼,CABODX, 卡博替尼,CABODX, 塞尔帕替尼,SEP 恩曲替尼,ENTRED 拉罗替尼, LARODX, 拉罗替尼,LARODX,L 比美替尼,MEKTODK, 特泊替尼Tepotinib 索托拉西布Lumakr Adlumiz阿那莫林说明 阿来替尼(安圣莎 赛沃替尼片(沃瑞 奥希替尼/奥西替尼 普拉替尼 (Pralset Trametinib 曲美替尼 Lumakras Tablets 240× 塞尔帕替尼Selper Selpercatinib 塞尔帕 Anlotinib 安罗替尼 替雷利珠单抗、百 普拉替尼,普吉华 赛沃替尼 Savoliti 艾弗沙、伏美替尼 阿美替尼,阿美乐 卡瑞利珠单抗 艾瑞 sumab(Xgeva) 地诺 恩沙替尼 (Ensarti 达拉非尼Dabrafeni 曲美替尼 迈吉宁 劳拉替尼Lorviqua Brigatinib布吉替尼 纳武利尤单抗/40 纳武利尤单抗/10 afatinib阿法替尼(吉 Osicent80奥希替尼 Osimert奥希替尼Os Dacocare达克替尼(
- 肾癌专区
- 胃直肠癌
- 骨髓血癌
- 白血病药品
- 奎扎替尼(Quizar 奎扎替尼(Quizar 阿西米尼(Ascimi 达沙替尼 20mg说明 吉瑞替尼,GILLID 维奈托克,VECLAD 恩西地平,ENASID 艾伏尼布, AIVODX, quizartinib,奎扎替 奎扎替尼quizartin 帕纳替尼(Ponatini 帕纳替尼(Ponatini 维奈克拉片(ven 普纳替尼(Ponati 阿西米尼(ascimi 阿西米尼/阿西米尼 阿扎胞苷片(Aza 艾伏尼布 吉列替尼 吉瑞替尼 阿伐曲泊帕(Ava 艾曲波帕(Revola Celrixafor释倍灵/普 Venetoclax 维奈托克 Ponaxen45普纳替尼 达沙替尼Dasatinib( 伊马替尼Gleevec,i 帕纳替尼Ponatinib 普纳替尼Ponatinix 伊马替尼|格列卫 达沙替尼 20mg 达沙替尼 50mg 达沙替尼 100mg 达沙替尼|施达赛 格列卫|伊马替尼片 格列卫|伊马替尼
- 新特药区
- 风湿骨病药品
- 非戈替尼(Filgot 非戈替尼(Filgot 托法替尼,TOFADX, 乌帕替尼,UPADX, 巴瑞替尼, BARUDX, 巴瑞替尼, BARUDX, 莫洛替尼momelotin 非戈替尼 乌帕替尼(upadac 乌帕替尼(upadacit 托法替布(5mg*60) 托法替尼(Tofaci 巴瑞克替尼、巴瑞 非布司他(优立通 非布司他 ZURIG 托法替尼Tocit 托法替尼Tofanib 托法替尼Tofacinix 非布司他 ZURIG80 托法替布Tofacitin 巴瑞克替尼 4mg 巴瑞克替尼 2mg
- 糖尿病药品
- 曲格列汀(Zafate 曲格列汀,TEGLID 非奈利酮(finereno 口服司美格鲁肽( 口服司美格鲁肽( 口服司美格鲁肽( Eudaxen(Diazoxide)二氮 恩格列净(欧唐静 琥珀酸曲格列汀( 恩格列净(欧唐静 曲格列汀(Zafatek) 曲格列汀片 50mg 曲格列汀片 100mg
- 特效药
- 阿普昔腾坦(Apr 达普司他(Daprod 维贝格龙(Vibegr 贝舒地尔(Berdaz 西多福韦(Cidofo 芦曲泊帕,LUTROD 阿那格雷(Anagreli 万赛维(盐酸缬更 艾曲波帕,ELTROM 艾曲波帕,ELTROM 阿伐曲波帕, AVAT 甲磺酸贝舒地尔片 非达霉素 醋酸环丙孕酮片( 斯佩格(SPEGRA) 印度迈兰Mylan三合 达可辉的作用与功 司帕生坦(sparse 泰毕全(达比加群 Rutinib-5(Ruxolitinib Tafero/EM达可挥( TAFFIC(必妥维)塔菲 Myltega特威凯(DTG)多 spegra斯佩格| 三合 奥贝胆酸Obetix
- 其他药品
普拉替尼(普吉华)说明书
本品为附条件批准,请仔细阅读说明书并在医师指导下使用
【药品名称】
通用名:普拉替尼
商品名:普吉华 Gavreto
全部名称:普拉替尼,普雷西替尼,帕拉西替尼,Pralsetinib,Gavreto
【适应症】
用于治疗RET融合阳性非小细胞肺癌(NSCLC)成人患者、12岁以上需要全身治疗的晚期或转移性RET突变甲状腺髓样癌(MTC)患者和需要全身治疗且放射性碘难治性晚期或转移性RET融合阳性甲状腺癌患者。
【用法用量】
成人推荐剂量为400毫克,每天空腹口服一次(服用GAVRETO前至少2小时不进食,服用后至少1小时内不进食)
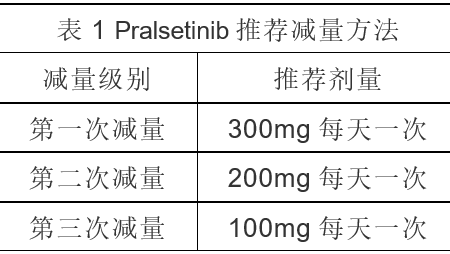
※剂量调整
如果因不良反应需要减量,按表1进行,当减至最低剂量时仍无法耐受不良反应时,永久停用Pralsetinib。
如果因不良反应需要调整给药方案,按表2进行。
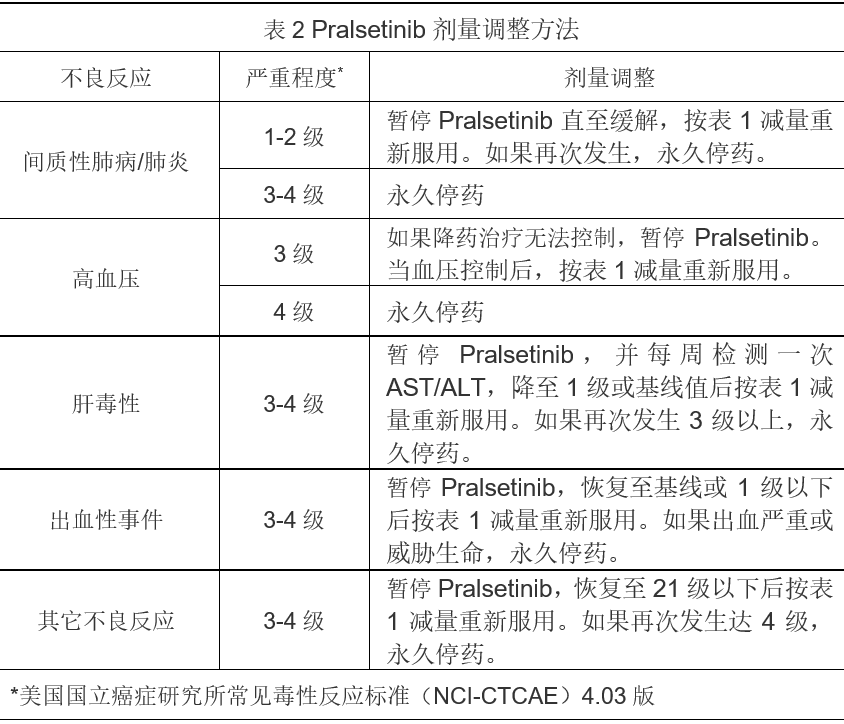
在服用Pralsetinib期间尽量避免使用强效CYP3A4和 P-gp抑制剂,如果不可避免时,按表3减量服用。
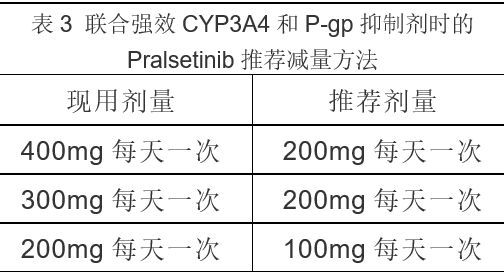
停用CYP3A4和P-gp抑制剂3-5个半衰期(约3-5天)后,恢复Pralsetinib原剂量。
在服用Pralsetinib期间尽量避免使用强效CYP3A4诱导剂,如果不可避免时,联用后第7天开始,Pralsetinib的剂量加倍。停用CYP3A4诱导剂14天后,恢复Pralsetinib原剂量。
患者轻度肝损害(总胆红素≤正常值上限和AST>正常值上限,或正常值上限<总胆红素<1.5倍正常值上限)时,无需调整剂量。
【不良反应】
本部分安全性数据来自ARROW 研究,220 例RET 融合阳性转移性非小细胞肺癌患者,中位年龄60 岁,52% 女性,50% 白人,Pralsetinib 400mg 每天一次。
严重不良反应的比例为45% ,最常见(≥2% )的为肺实质病变,肺炎,败血症,尿路感染和发热。5% 的患者发生致命不良反应,其中超过1 例的为肺实质病变3 例和败血症2 例。
15% 的患者因不良反应永久停药,最常见的原因为肺炎(1.8% ),肺实质病变(1.8% )和败血症(1% )。
60% 的患者因不良反应暂停药物,最常见的原因为中性粒细胞减少,肺炎,贫血,高血压,肺实质病变,发热,AST 升高,肌酸激酶升高,乏力,白细胞减少,血小板减少,呕吐,ALT 升高,败血症和呼吸困难。
36% 的患者因不良反应减量,最常见的原因为中性粒细胞减少,贫血,肺炎,乏力,高血压,肺实质病变和白细胞减少。
最常见的不良反应(≥25%)是疲劳、便秘、肌肉骨骼疼痛和高血压。
最常见的3-4级实验室异常(≥2%)为淋巴细胞减少、中性粒细胞减少、磷酸盐降低、血红蛋白降低、钠减少、钙减少和丙氨酸转氨酶(ALT)升高。
禁忌:无。
【注意事项】
间质性肺病(ILD)/肺炎:出现1级或2级反应停止用药直到分解,然后以低剂量恢复用药。因复发性ILD/肺炎而永久停药。3级或4级反应永久停止。
高血压:没控制住高血压的患者不要使用GAVRETO。在开始GAVRETO之前优化血压。1周后监测血压,此后至少每月监测一次,并根据临床指示。根据严重程度,停用、减少剂量或永久停用GAVRETO。
肝毒性:在开始使用GAVRETO前,在前3个月每2周监测一次ALT和AST,此后每月监测一次,并根据临床指示进行监测。根据严重程度,停用、减少剂量或永久停用GAVRETO。
出血事件:对严重或危及生命的出血患者,永久停止GAVRETO。
伤口愈合受损的风险:择期手术前至少5天不要使用GAVRETO。在大手术后至少2周内,在伤口愈合之前,不要用药。伤口愈合并发症缓解后恢复使用GAVRETO的安全性尚未确定。
胚胎-胎儿毒性:可对胎儿造成伤害。女性生殖潜能对胎儿具有潜在风险,建议使用有效的非激素避孕措施。
【药物与药物相互作用】
强CYP3A抑制剂:避免联合用药。
联合P-gp和强CYP3A抑制剂:避免联合用药。如果不能避免联合用药,则应减少GAVRETO的剂量。
强CYP3A诱导剂:避免联合用药。如果不能避免合用,增加GAVRETO的剂量。
【作用机制】
普雷西替尼是野生型RET和致癌RET融合(CCDC6-RET)和突变(RET V804L、RET V804M和RET M918T)的激酶抑制剂,其半数最大抑制浓度(IC50s)小于0.5nm。在纯化酶分析中,普雷西替尼抑制DDR1、TRKC、FLT3、JAK1-2、TRKA、VEGFR2、PDGFRb和FGFR1的浓度较高,但在Cmax下仍能达到临床要求。在细胞检测中,普雷西替尼抑制RET的浓度分别比VEGFR2、FGFR2和JAK2低约14倍、40倍和12倍。
某些RET融合蛋白和激活点突变可通过下游信号通路的过度激活来驱动致瘤潜能,从而导致不受控制的细胞增殖。在含有癌性RET融合或突变的培养细胞和动物肿瘤植入模型中,普雷西替尼具有抗肿瘤活性,包括KIF5B-RET、CCDC6-RET、RET M918T、RET C634W、RET V804E、RET V804L和RET V804M,普雷西替尼可延长小鼠颅内植入表达KIF5B-RET或CCDC6-RET肿瘤模型的存活时间。
【安全与疗效】
在一项多中心、非随机、开放性、多组临床试验中,评估了GAVRETO对RET融合阳性转移性NSCLC患者的疗效(ARROW,NCT03037385)。这项研究在不同的组中纳入了转移性RET融合阳性的非小细胞肺癌患者,这些患者接受了基于铂类药物的化疗,以及未接受过治疗的转移性非小细胞肺癌患者。当地实验室通过下一代测序(NGS)、荧光原位杂交(FISH)和其他测试确定RET基因融合。在目标人群114例患者中,回顾性地对使用Dx靶向测试的患者中的59例(使用Dx技术)患者进行疗效测试。纳入无症状中枢神经系统(CNS)转移瘤患者,包括在被纳入研究前2周内类固醇使用稳定或减少的患者。患者每天口服一次,剂量为400mg,直到疾病进展或出现不可接受的毒性。
根据RECIST v1.1,主要疗效预后指标为总缓解率(ORR)和缓解持续时间(DOR),由一个盲法独立中心审查(BICR)评估。
先前经过铂类化疗的转移性RET融合阳性NSCLC
对87例RET融合阳性的NSCLC患者进行疗效评估,这些患者以前接受过铂类化疗,纳入ARROW试验组。
中位年龄为60岁(范围:28至85岁);49%为女性,53%为白人,35%为亚裔,6%为西班牙裔/拉丁裔。ECOG表现为0-1(94%)或2(6%),99%的患者有转移性疾病,43%有中枢神经系统转移史或目前有转移史。患者平均接受过2次全身治疗(范围1-6);45%的患者接受过抗PD-1/PD-L1治疗,25%接受过激酶抑制剂治疗。共有52%的患者接受过放射治疗。77%使用NGS的患者(45%的肿瘤样本;26%的血液或血浆样本,6%未知)检测到RET融合,21%使用FISH,2%使用其他方法。最常见的RET融合药物是KIF5B(75%)和CCDC6(17%)。
对于39例接受抗PD-1或抗PD-L1治疗的患者,无论是依次还是同时接受铂类化疗,ORR的探索性亚组分析为59%(95%CI:42,74),而DOR中位数没有达到(95%CI:11.3,NE)。
在87例RET融合阳性的NSCLC患者中,8例在接受BICR基线检查时有明显的CNS转移。在进入研究前2个月内,没有患者接受脑部放射治疗。8例患者中有4例出现颅内病变反应,其中2例CNS完全缓解;75%的患者DOR≥6个月。
未经治疗的RET融合阳性NSCLC
对27例未经治疗的RET融合阳性的NSCLC患者进行疗效评估,并将可测量的疾病纳入ARROW。
中位年龄为65岁(30至87岁);52%为女性,59%为白人,33%为亚裔,4%为西班牙裔或拉丁裔。96%的患者的ECOG表现为0-1,所有患者(100%)有转移性疾病,37%有中枢神经系统转移史或目前有转移。67%使用NGS的患者(41%肿瘤样本;22%的血液或血浆;4%未知)和33%使用FISH的患者检测到RET融合。最常见的RET融合药物是KIF5B(70%)和CCD6(11%)。
【普吉华贮藏】
在20°C至25°C(68°F至77°F)下储存;允许有15°C至30°C(59°F至86°F)的温差。
注:开启后保持原包装防潮贮藏,请勿丢弃包装中的干燥剂。
【普吉华包装】
药用高密度聚乙烯瓶及聚丙烯瓶盖包装,内置聚乙烯纤维袋装药用干燥剂(合成非晶态沉淀硅胶)。
60粒/瓶,1瓶/盒; 90粒/瓶, 1瓶/盒; 120粒/瓶, 1瓶/盒。
【普吉华有效期】24个月
【普吉华执行标准】JX20210026
【普吉华批准文号】国药准字HJ20210018
印度肿瘤药房(India Pharmacy)是印度新德里肿瘤药房信息咨询服务平台,旨在为患者提供各类进口原研 进口仿制 最新研制等医药信息咨询 跨境医药电商直邮服务,让患者轻松获取全球最佳药品有更多选择,基本涵盖新特药 抗癌药 靶向药 丙肝 乙肝 高血压 糖尿病 痛风 等药品,欢迎咨询!官方微信 yindu948


![[field:title /]](/style/images/star.png)




