Exkivity (mobocertinib)对NSCLC的疗效如何?
发布日期:2024-02-28 浏览次数:
注:2023年10月2日,武田药品宣布Exkivity自愿退出美国和全球市场。Exkivity未达到3期EXCLAIM-2验证性试验的主要终点,也不符合FDA授予的用于治疗NSCLC的加速批准的要求。
要点
通过观察总体缓解率 (ORR) 和对治疗的反应持续时间 (DoR) 来确定 Exkivity 的有效性。
在临床研究中,114 例非小细胞肺癌 (NSCLC) 患者中有 32 例 (28%) 对 Exkivity 治疗有部分反应。在这些患者中,对治疗的反应持续了约17.5个月。
近 59% 的有反应的患者有持续至少 6 个月的反应。中位总生存期为24个月(2年)。

Exkivity研究结果
2021年9月,FDA根据一项名为“研究101”的临床研究,加速批准了Exkivity(mobocertinib)。这项研究包括 114 名非小细胞肺癌 (NSCLC) 患者,这些患者已经扩散到身体的其他部位,无法通过手术切除。这些患者的肺癌中具有EGFR外显子20插入突变,这是通过特殊测试确定的。
患者正在接受或以前接受过含有铂的化疗,但他们的病情恶化了。在这项研究中,参与者每天一次接受 160 毫克口服剂量的 Exkivity,直到他们的肺癌恶化或出现无法忍受的副作用。
Exkivity 的有效性是通过观察总体缓解率 (ORR) 和缓解持续时间 (DoR) 来确定的。ORR 着眼于有多少人使用 Exkivity 看到了肿瘤反应,如缩小。DoR 衡量响应持续了多长时间。
总体而言,约28%的人(32/114)对Exkivity治疗有部分反应,反应持续了约17.5个月。近 59% 的有反应的患者 (19/32) 有持续至少 6 个月的反应。中位总生存期为24个月(2年)。中位数意味着一半的人寿命超过24个月,另一半人的寿命少于24个月。
2023年10月2日,武田药品宣布自愿退出Exkivity,原因是加速批准验证性研究未达到要求的终点。
Exkivity 常见副作用
Exkivity研究101中报告的最常见的副作用(>20%)是:腹泻;皮疹;口腔溃疡;呕吐;食欲下降;指甲周围皮肤感染;恶心;肌肉或骨骼疼痛;干性皮肤;感觉疲倦。
Exkivity 标签带有针对 QTc 间期延长和尖端扭转型室性心动过速(危险心律类型)的方框警告、针对某些类型的肺或心脏毒性和腹泻的警告。
什么是Exkivity?
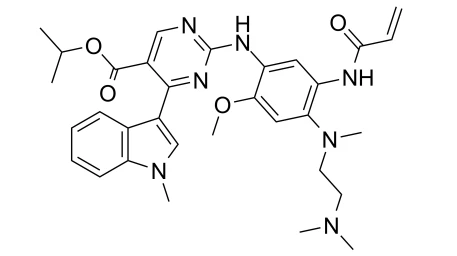
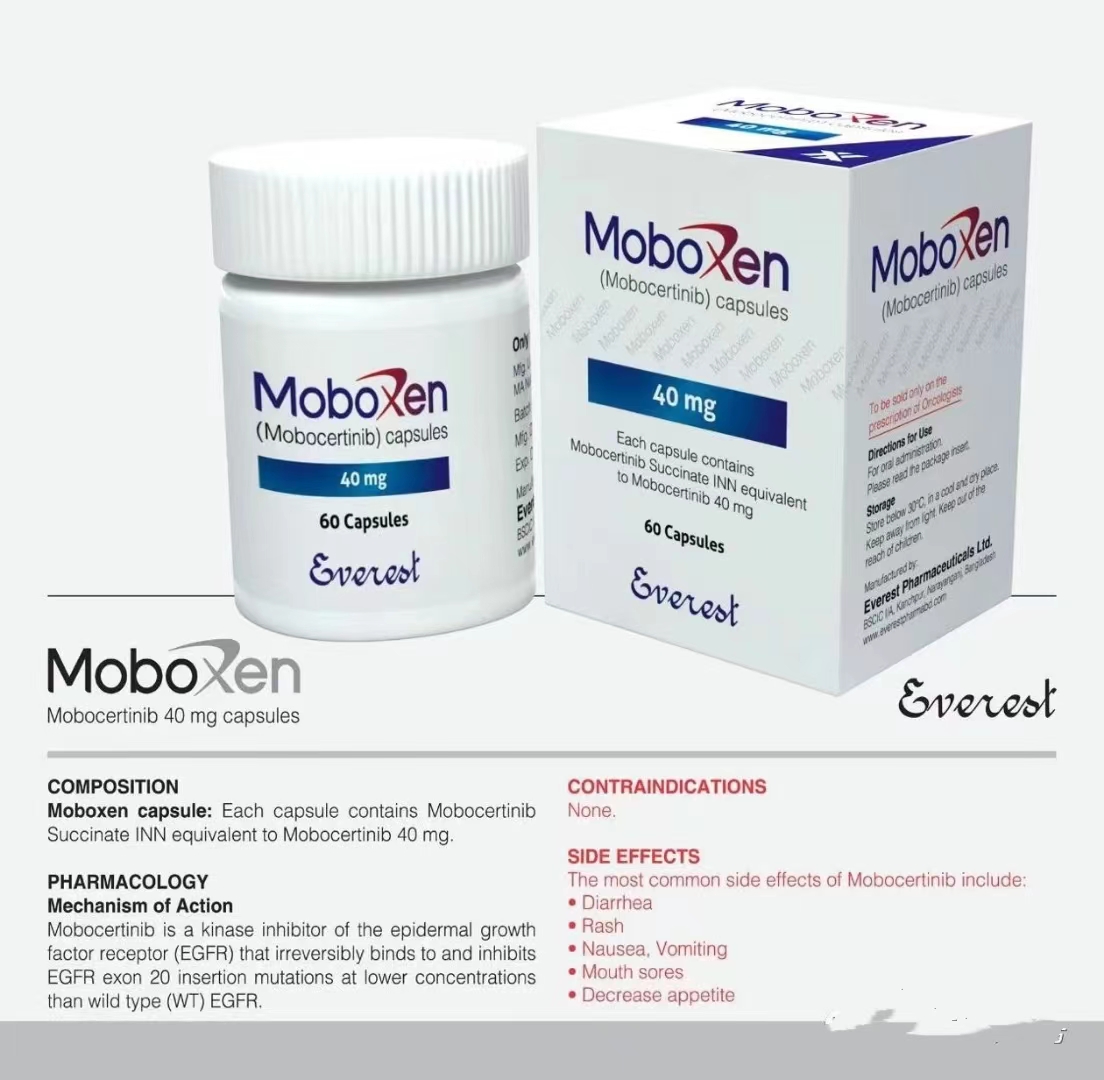
Exkivity (mobocertinib)是一种口服激酶抑制剂,先前被批准用于治疗伴有表皮生长因子受体(EGFR)外显子20插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者,这些突变在铂类化疗期间或之后进展。这是一种专门针对EGFR外显子20插入突变而设计的同类首创口服疗法。
当可用时,Exkivity 以 40 毫克胶囊的形式出现。推荐剂量为 160 毫克(4 粒胶囊),口服,每日一次,随餐或不随餐均可。
印度肿瘤药房(India Pharmacy)是印度新德里肿瘤药房信息咨询服务平台,旨在为患者提供各类进口原研 进口仿制 最新研制等医药信息咨询 跨境医药电商直邮服务,让患者轻松获取全球最佳药品有更多选择,基本涵盖新特药 抗癌药 靶向药 丙肝 乙肝 高血压 糖尿病 痛风 等药品,欢迎咨询!官方微信 Yindu7689


