免疫治疗正式进军早期NSCLC:T药率先获批,O药当仁不让!
发布日期:2022-03-31 浏览次数:
肺癌的发病率和死亡率均居我国恶性肿瘤第一位,其中80%-85%的患者为非小细胞肺癌(NSCLC)。随着研究发现,免疫治疗不但已经成为驱动基因阴性晚期NSCLC的标准治疗方案,而且在早期NSCLC患者的新辅助治疗与辅助治疗中也有了全面发展!早期的NSCLC患者可以通过手术治疗,但仍有部分患者在术后会复发转移,因此免疫治疗关口前移、应用于早期可手术患者成为了近年来的研究热点。
在今年的CSCO大会上,就早期免疫治疗NSCLC多项研究显示,化疗的获益有限,LACE meta分析表明辅助化疗5年无病生存(DFS)率提高约为6%,5年总生存(OS)提高约5%。另一项包含15项研究的meta分析提示新辅助化疗5年OS率也仅提高5%。早期肺癌患者亟需更有效的围术期治疗手段以改善局部复发和长期生存。
2021 年 10 月 16 日,FDA 批准了 atezolizumab (阿替利珠单抗,T药)用作切除术和铂类化疗后的辅助治疗以及由 Ventana Medical Systems, Inc. 开发的 VENTANA PD-L1 (SP263) 检测设备,用作辅助诊断设备用作切除术和铂类化疗后的辅助治疗,用于 II 至 IIIA 期非小细胞肺癌患者。这是第一个也是唯一一个可用于 NSCLC 辅助治疗的癌症免疫疗药物,是肿瘤药物发展史的重要里程碑!

该申请批准是根据IMpower010(NCT02486718) Ⅲ 期试验数据,共有 1280 名患者纳入了该实验并接受了顺铂 培美曲塞/吉西他滨/多西他赛/长春瑞滨治疗1至4个周期,然后其中1005名患者以1:1的比例随机接受每21天1200mg的T药或BSC。
该试验的主要终点是研究者评估的 DFS,该 DFS 进行了分层测试:
(1)II 至 IIIA 期疾病且 PD-L1 表达为 1% 或更高的患者;
(2)II 至 IIIA 期疾病的所有随机患者;
(3)意图IB 至 IIIA 期疾病的治疗 (ITT) 人群。
次要终点包括:ITT 人群的总生存期 (OS)、PD-L1 表达≥50% 的 II 至 IIIA 期疾病患者的 DFS,以及所有 3 个人群的 3 年和 5 年 DFS .
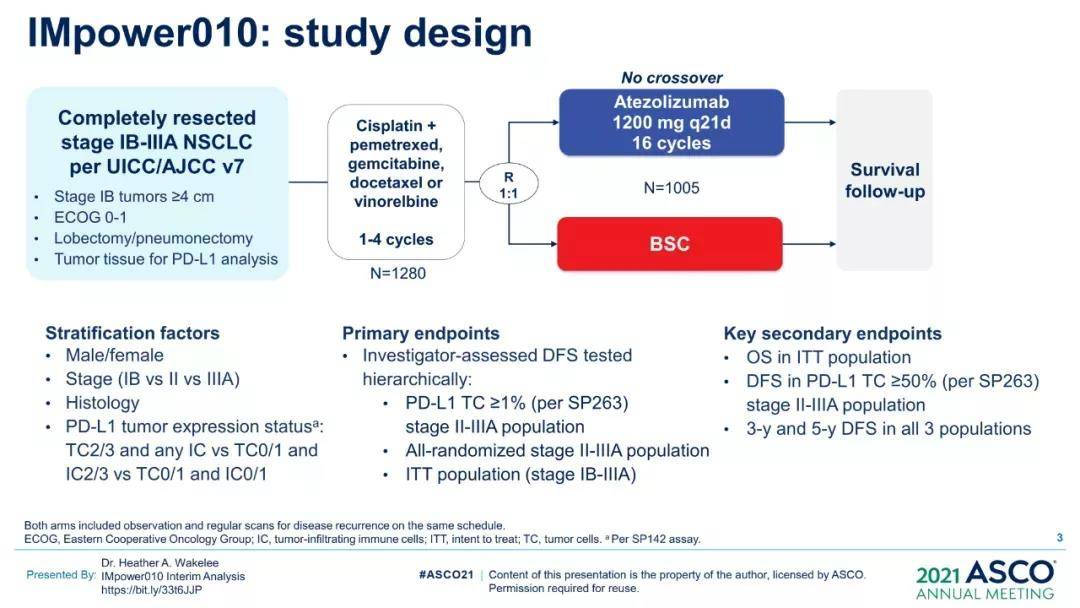
根据在2021年ASCO年会上更新的最新数据显示,中位随访时间为32.2个月(范围,0.57-5),在PD-L1 TC≥1%的Ⅱ~ⅢA期患者中,虽然T药组尚未达到中位无病生存期(DFS),但是T药相比对照组有显示的DFS获益,对照组中位DFS为35.3个月(HR=0.66,95%CI: 0.50~0.88,P=0.004),36个月DFS率60.0% vs 48.2%。
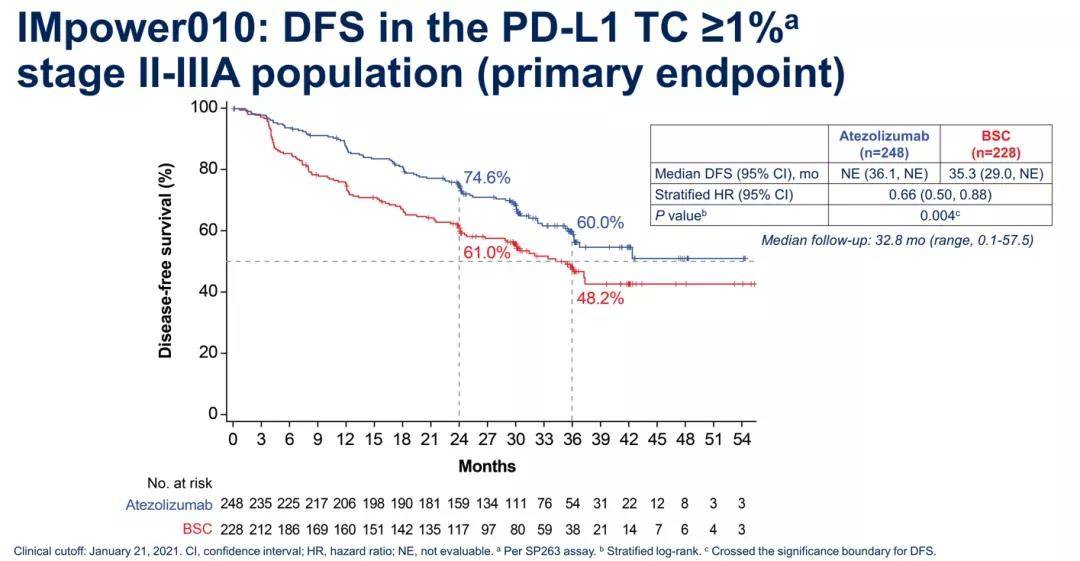
研究组和对照组中所有随机化任何PD-L1表达的II和IIIA期人群的中位无病生存期(DFS)为42.3个月(95% CI,36.0–NE)和35.3个月(95% CI,30.4-46.4HR,0.79;95% CI,0.64-0.96;P =0.02);
在 ITT 人群中,研究组 (n = 507) 和对照组 (n = 498) 的中位 DFS 分别不可评估(95% CI, 36.1–NE)和 37.2 个月(95% CI, 31.6–NE) (HR,0.81;95% CI,0.67-0.99;P =0.04)。
从实验中的II-IIIA期NSCLC患者数据结果来看,与最佳支持治疗(BSC)相比,T药的加入与复发或死亡风险的小幅度降低相关,中位随访32.2个月后的HR为0.79 (P=0.02);在ITT人群分析中,T药降低复发或死亡风险的幅度具有临界意义,中位随访32.2个月后的风险比为0.81(P=0.04)。
更有中期分析的早期 OS 数据显示,在 II 至 IIIA 期疾病和 PD-L1 表达为 1% 或更高的患者亚组中,HR 为 0.77(95% CI,0.51-1.17),在 II 期至 IIIA 期疾病的所有随机人群中0.99(95% CI) , 0.72-1.33) ,在 ITT 人群中为 1.07 (95% CI, 0.80-1.42)。
接受T药治疗的患者最常报告的不良反应包括天冬氨酸转氨酶、血肌酐和丙氨酸转氨酶升高。其他毒性包括高钾血症、皮疹、咳嗽、甲状腺功能减退、发热、疲劳/虚弱、肌肉骨骼疼痛、周围神经病变、关节痛和瘙痒。
关口前移,布局新辅助治疗,
O药用实力说话!
CheckMate-159研究已证实,纳武利尤单抗单药和在纳武利尤单抗基础上联合含铂化疗,用于早期患者新辅助治疗的疗效。2020年10月,III期临床研究CheckMate-816达到病理完全缓解(pCR)的主要研究终点,该研究结果于2021年4月在美国癌症研究协会 (AACR) 年会上公布,证实O药联合化疗作为新辅助治疗能够为非小细胞肺癌患者带来获益。该研究是首个也是目前唯一证实免疫检查点抑制剂联合化疗能够为非小细胞肺癌患者带来获益的III期临床研究。
CheckMate-816是一项随机、开放标签、多中心III期临床研究,旨在评估与单用化疗相比,纳武利尤单抗联合化疗用于可切除非小细胞肺癌患者新辅助治疗的疗效。研究纳入358例 Ib至IIIa期的可切除NSCLC患者,术前随机接受O药(360 mg)联合基于组织学分型的含铂双药化疗(每3周一次,最多3个周期),或者单用含铂双药化疗(每3周一次,最多3个周期)。主要研究终点是pCR率(pCR即经盲态独立病理审核后手术切除标本中未发现癌细胞)和无事件生存期(EFS),关键次要终点包括总生存期(OS)、主要病理缓解(MPR,MPR即手术切除标本中的肿瘤细胞比例降低到≤10%),以及至死亡或远处转移的时间。
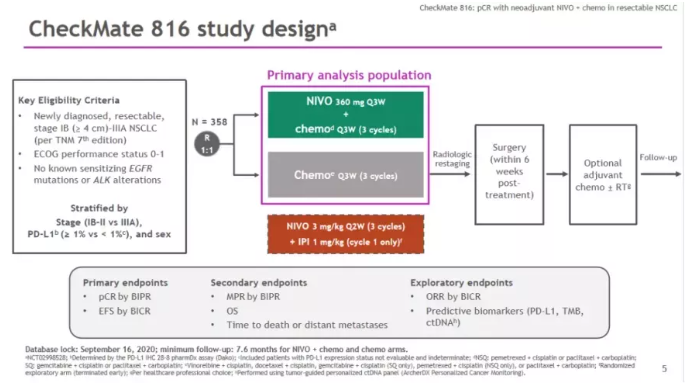
结果显示,意向治疗人群(ITT人群)中术前接受纳武利尤单抗和化疗组的pCR率分别是24% VS 2.2%(比值比 [OR] 13.94,99%置信区间[CI]:3.49-55.75; p<0.0001),pCR率翻了十倍不止,以压倒性的优势达到主要研究终点。
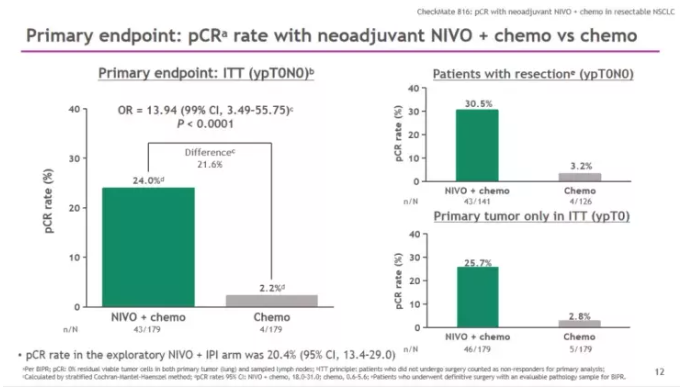
关键次要研究终点MPR翻四倍!(36.9% vs 8.9%;比值比[OR] 5.70, 99%置信区间[CI]: 3.16-10.26),安全性特征与过往研究一致,未发现新的治疗相关不良事件类型。
10倍的pCR率、4倍的MPR率,让CheckMate-816成为业内关注的焦点,在关注化免联合新辅助治疗是否能够为患者带来获益的同时,化免联合新辅助治疗是否会对患者后续的手术治疗造成影响同样是业界关注的焦点。
CheckMate-816研究手术治疗结局数据显示,化免联合新辅助不影响手术治疗、不影响手术治疗方式及程度、病理缓解深度更强、安全性可控是早期NSCLC免疫治疗史上里程碑。新辅助治疗获得成熟的长期生存数据往往需要数十年,但从目前10倍于化疗的pCR率上看,最终OS数据也是值得期待的,有望改变未来的临床实践,为更多早期NSCLC患者带来更好的生存获益!
印度肿瘤药房(India Pharmacy)是印度新德里肿瘤药房信息咨询服务平台,旨在为患者提供各类进口原研 进口仿制 最新研制等医药信息咨询 跨境医药电商直邮服务,让患者轻松获取全球最佳药品有更多选择,基本涵盖新特药 抗癌药 靶向药 丙肝 乙肝 高血压 糖尿病 痛风 等药品,欢迎咨询!官方微信 Yindu7689


