预计2021年,美国将诊断出超过14480例浸润性宫颈癌新病例,4290名女性将死于该病。宫颈癌仍然是全球女性癌症死亡的主要原因之一,2018 年已经有超过 311,000 名女性死于该病。更可怕的是,一旦宫颈癌复发或转移,临床上的治疗选择非常有限,迫切需要更有效的治疗方案。
9月20日,Genmab和Seagen公司共同宣布,美国食品和药物管理局 (FDA) 已加速批准TIVDAK™(tisotumab vedotin-tftv),用于治疗在化疗中或化疗后疾病进展的复发性或转移性宫颈癌成人患者。值得一提的是,TIVDAK™是宫颈癌的第一个也是目前唯一一个获批的抗体药物偶联物(ADC)。
“ TIVDAK 在美国被批准作为单一疗法对于在化疗期间或之后疾病进展的复发性或转移性宫颈癌女性来说是一个重要的里程碑,因为她们需要一种新的治疗选择,我们期待为她们提供这种选择, ” Genmab 首席执行官 Jan van de Winkel 博士说。“

来源:Seagen官网
客观缓解率24%,宫颈癌首款ADC疗法获批上市
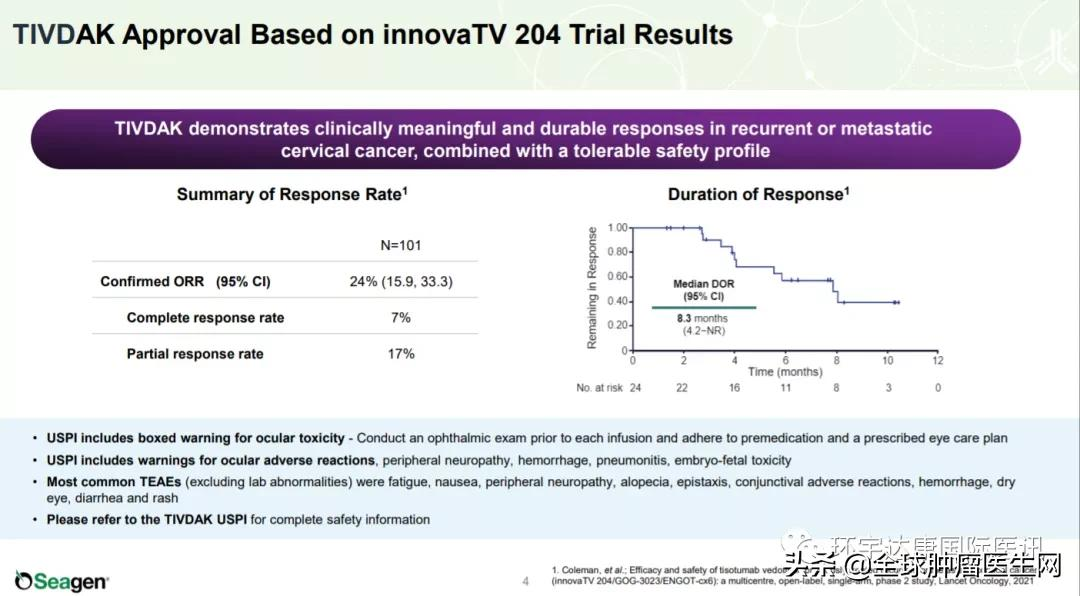
FDA的此次批准是基于代号为innovaTV 204 临床试验的积极数据。
共有101名复发或转移性宫颈癌患者接受tisotumab vedotin治疗,这些患者之前接受了不超过两种的系统性治疗方案,包括至少一种基于铂类化疗方案。
结果显示,客观缓解率(ORR) 为 24%(95% CI;15.9-33.3)。中位缓解持续时间 (DOR) 为 8.3 个月(95% CI;4.2 -未达到)。
来源:Seagen官网
初识TIVDAK(tisotumab vedotin-tftv)
TIVDAK 是一种针对组织因子(一种在宫颈癌细胞上表达的蛋白质)的一流抗体药物偶联物 。
TIVDAK (tisotumab vedotin-tftv) 是一种抗体偶联药物(ADC),由 Genmab 的针对组织因子 (TF) 的人单克隆抗体和 Seagen 的 ADC 技术组成,该技术利用蛋白酶可切割的接头将微管破坏剂单甲基 auristatin E (MMAE) 共价连接到抗体。非临床数据表明 TIVDAK 的抗癌活性是由于 ADC 与表达 TF 的癌细胞结合,随后通过蛋白水解裂解释放 MMAE。MMAE 破坏了活跃分裂细胞的微管网络,导致细胞周期停滞和细胞凋亡。在体外,TIVDAK 还介导抗体依赖性细胞吞噬作用和抗体依赖性细胞毒性。
希望TIVDAK的上市能给晚期宫颈癌患者带来更多的选择和希望。
除此之外,众多宫颈癌新药正在研发中,其中两款数据惊艳的“双抗”药物AK104、M7824等国内中心临床试验均在招募患者。



