奥希替尼耐药后如何选择?
发布日期:2021-01-04 浏览次数:

奥希替尼是第三代表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI),现已在全球范围内用于治疗EGFR TKI耐药后T790M突变的晚期非小细胞肺癌(NSCLC)。接受治疗的患者取得较高的的客观缓解率(ORR),中位无进展生存期(PFS)接近10个月。
随着奥希替尼的广泛应用,获得性耐药仍然是不可避免的临床问题。目前已经发现一系列的耐药机制,包括EGFR C797S突变,MET扩增和小细胞转化等。在今年ASCO会议上,有多项关于奥希替尼耐药机制的研究报道。
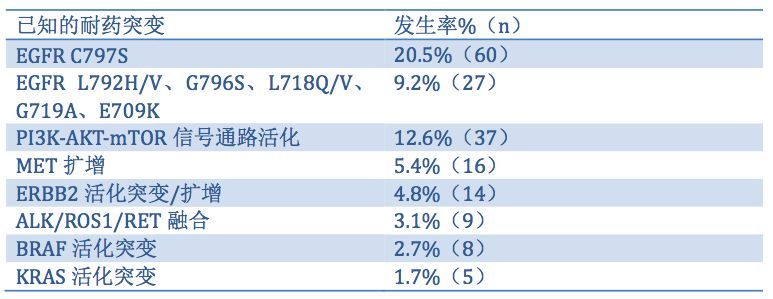
表1 最常见的已知的耐药机制及其发生率
为了探索奥希替尼耐药后的分子机制,来自美国Dana Faber癌症研究所的Geoffrey R. Oxnard博士以及团队开展了一项较大队列的耐药性研究,研究结果于近日发表在JAMA Oncology杂志上。
研究方法
研究人员从4个癌症中心筛选了143例接受奥希替尼单药治疗的EGFR T790M突变(组织或血浆检测确认)阳性晚期NSCLC患者,此外,首次人体试验AURA的患者作为验证队列纳入本次研究。奥希替尼的疗效评估采用至治疗中断时间(TTD),定义为以服药起点至任何原因导致的停药。
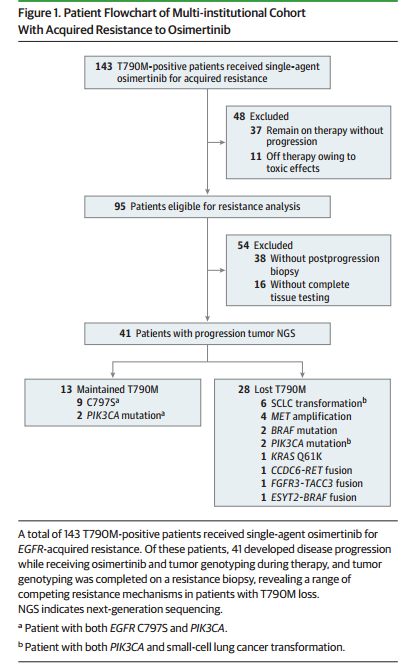
图1 入组流程
研究结果
在143名患者中,41名(28名[68%]女性)患者出现耐药接受了肿瘤下一代基因测序(NGS)。13名患者(32%)中仍可检测到T790M突变,9名患者(22%)观察到EGFR C797S突变。28名T790M突变消失的患者中,一些与意外的耐药机制相关,包括RET,FGFR3,BRAF融合和KRAS等。
保留T790M突变患者中女性比例更高,两组患者的其余临床特征相似。耐药后T790M突变消失的患者中位TTD较短(6.1 vs.15.2个月),表明T790M突变消失患者会出现早期耐药。
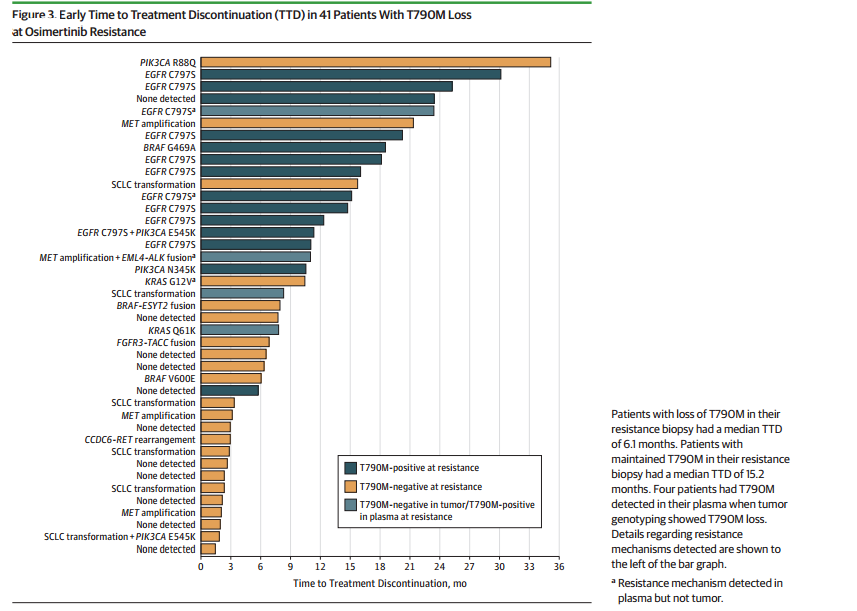
图2 TTD
这一发现在110例AURA研究中的患者的回顾性分析中得到证实,其中52名患者出现T790M突变消失。在维持T790M突变的58名患者中,24名患者检测到EGFR C797S突变。T790M突变消失的患者mTTD为5.5个月,而维持T790M突变的患者mTTD约为12.4个月。分析显示,38例停药时间<5.5个月的患者中有28例T790M突变消失,而36例T790M保留患者中有26例停止治疗时间>13个月。
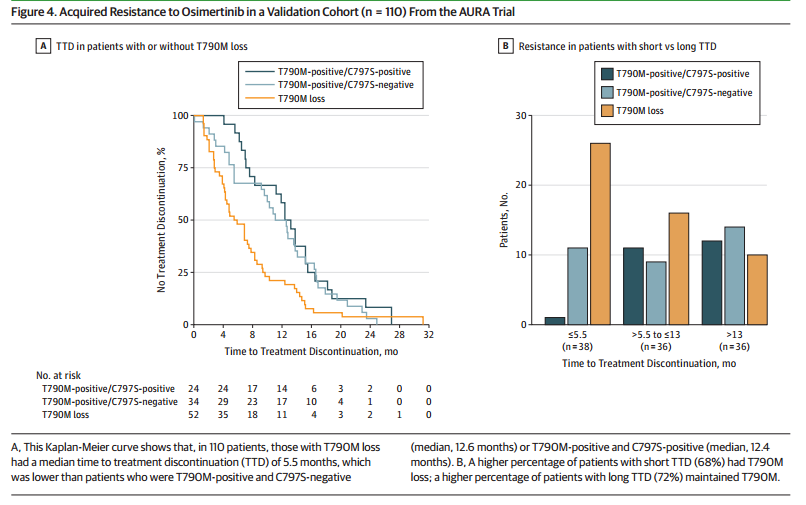
图3 AURA研究队列
研究人员通过血浆基因型分析来预估患者最终的耐药模式。来自AURA队列的50名患者在奥希替尼治疗前后进行血浆型分析。通过计算T790M与EGFR的相对AF显示,奥希替尼耐药前后的T790M突变的相对AF显著相关(相关系数= 0.70; P <.001)。当采用二分法(即奥希替尼治疗前和治疗后)分析时,耐药后T790M突变消失的患者,奥希替尼治疗前T790M突变的相对AF略低(29% vs 38%,P=0.06)。
然后研究者分析了系列血浆基因型以评估血浆中的早期反应是否可以预测最终的耐药模式。研究队列中共19例患者血浆标本表现为早期反应,且奥希替尼治疗前和耐药的标本均可以检测到肿瘤DNA。耐药后血浆标本ctDNA浓度下降的患者,8例保留T790M突变,11例T790M突变消失,这两类患者中均观察到奥希替尼治疗后血浆T790M突变浓度的下降。进一步比较奥希替尼治疗后血浆EGFR敏感突变和T790M突变模式的变化(ΔDriver– ΔT790M),结果发现T790M突变消失患者和T790M突变保留患者耐药后的差异具有显著统计学意义(16% vs 0%,P=0.003)。
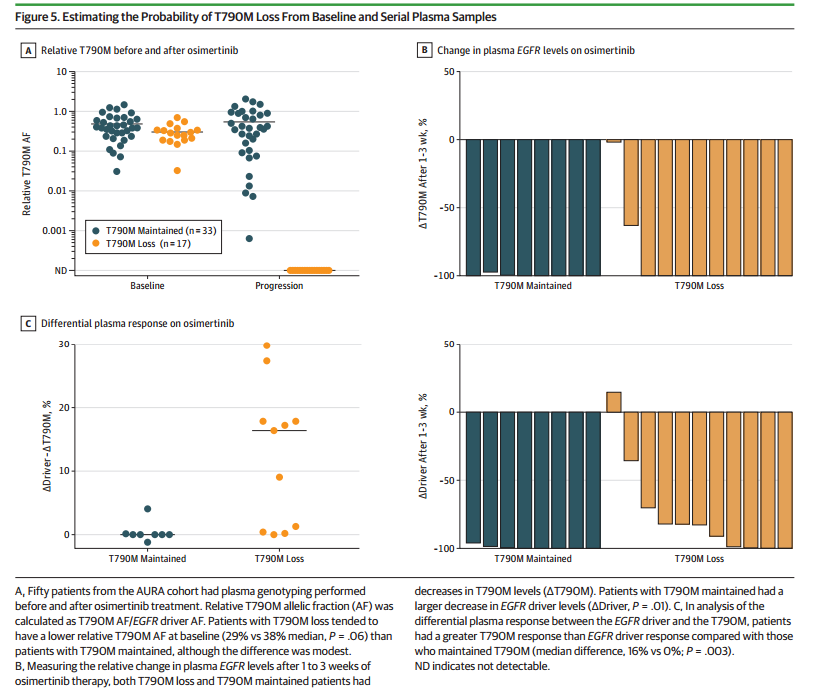
图4 评估最终耐药机制
研究结论
数据表明,EGFR T790M是一种关键的生物标志物,不仅可以用于预测患者接受奥希替尼治疗的敏感性,还可以了解奥希替尼耐药的生物学机制。对于奥希替尼耐药的患者,耐药后重新检测T790M突变,是指导后续治疗的重要步骤。
总而言之,奥希替尼耐药机制相对复杂,如果耐药后再次进行基因检测,找到活跃靶点,可以考虑相应靶点的药物治疗,但是很多仍处于摸索阶段,没有大宗的研究证实,也因为各类突变的少见性和复杂性,使得临床试验的设计和开展非常有限,我们可以根据目前得到的一些证据来选择用药。同时,换一种思路,如果尝试联合免疫检查点抑制剂、抗血管生成治疗等,从另一种角度攻克肿瘤,或许会收获不错的效果。奥希替尼耐药后的治疗策略,需要综合评估与制定。
印度肿瘤药房(India Pharmacy)是印度新德里肿瘤药房信息咨询服务平台,旨在为患者提供各类进口原研 进口仿制 最新研制等医药信息咨询 跨境医药电商直邮服务,让患者轻松获取全球最佳药品有更多选择,基本涵盖新特药 抗癌药 靶向药 丙肝 乙肝 高血压 糖尿病 痛风 等药品,欢迎咨询!官方微信 yigou120
- 上一篇:不止是化疗,一文了解淋巴瘤的六类免疫治疗制剂
- 下一篇:ER阳性乳腺癌患者的系统治疗


