PSMA阳性前列腺癌新药!FDA批准靶向放射配体疗法Pluvicto
发布日期:2022-03-27 浏览次数:次
PSMA 为前列腺癌细胞中高度表现(>80%)的生物标记物,在评估前列腺癌转移程度中扮演著关键的角色。Pluvicto由诺华制药研发,在给药进入体内循环的血液后,可靶向表达跨膜蛋白PSMA的前列腺癌细胞相结合。一旦结合,放射性同位素的能量发射会损伤靶细胞和附近的细胞,破坏它们的复制能力和/或引发细胞凋亡。
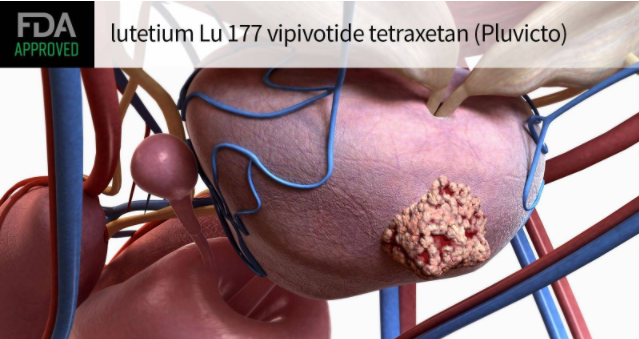
据3月23日诺华公司新闻稿公布,美国食品药品监督管理局(FDA)已批准Pluvicto(lutetium Lu 177 vipivotide tetraxetan) (以前称为177Lu-PSMA-617)用于治疗患有已扩散至身体其他部位(转移性)的晚期前列腺特异性膜抗原阳性转移性去势抵抗性前列腺癌(PSMA阳性mCRPC)的成人患者。这些患者已经接受了其他抗癌治疗(雄激素受体途径抑制和紫杉类化疗)。
这是FDA批准的首种针对mCRPC符合条件患者的靶向放射性配体疗法(RLT),该疗法将靶向化合物(配体)与治疗性放射性同位素(放射性粒子)相结合。Pluvicto预计将在数周内提供给医生和患者。
同时,FDA还批准了补充诊断成像剂Locametz(镓GA 68 gozetotide注射剂制备试剂盒)。放射性标记后,可使用该显像剂通过正电子发射断层扫描(PET)识别mCRPC成人患者的PSMA阳性病变。
镓-68标记的Locametz可识别表达PSMA生物标志物的肿瘤病变,并定位体内肿瘤可能扩散的位置(如软组织、淋巴结或骨),从而确定患者是否适合接受Pluvicto靶向治疗。
FDA批准Pluvicto是基于III期VISION试验的结果。这是一项国际性、前瞻性、随机、非盲、多中心、III期研究,评估了研究组Pluvicto(每6周静脉输注7.4 GBq,最多6个周期)+研究者选择的护理标准与对照组护理标准的疗效和安全性。
接受雄激素受体(AR)途径抑制和紫杉类化疗的PSMA-PET扫描阳性的mCRPC患者按2:1的比例被随机分配到研究组。备选主要终点为rPFS和OS。该研究纳入了831名患者。
该试验表明,先前接受雄激素受体(AR)途径抑制和紫杉烷类化疗的PSMA阳性mCRPC患者接Pluvicto+护理标准治疗后,与单独接受护理标准治疗相比,总体生存率有所提高。
与单独使用护理标准相比,使用Pluvicto+护理标准治疗的受试者死亡风险降低38%,放射影像学疾病进展或死亡风险降低(rPFS)具有统计学意义。由于对照组中从早期脱落开始的高度审查,对rPFS效应幅度的解释是有限的。
此外,大约三分之一 (30%) 的基线可评估疾病患者在使用 Pluvicto 加护理标准时表现出总体反应(根据 RECIST 1.1),而单用护理标准组的这一比例为 2%。Pluvicto 研究组最常见的不良事件(所有级别)是疲劳、口干、恶心、贫血(红细胞计数低)、食欲减退和便秘。
印度肿瘤药房(India Pharmacy)是印度新德里肿瘤药房信息咨询服务平台,旨在为患者提供各类进口原研 进口仿制 最新研制等医药信息咨询 跨境医药电商直邮服务,让患者轻松获取全球最佳药品有更多选择,基本涵盖新特药 抗癌药 靶向药 丙肝 乙肝 高血压 糖尿病 痛风 等药品,欢迎咨询!官方微信Yindu7689
