万赛维(盐酸缬更昔洛韦片)
万赛维(盐酸缬更昔洛韦片)是更昔洛韦(ganciclovir)的前体药物,是一种活性更昔洛韦缬氨酸酯。它口服后可在肠道和肝脏细胞中被磷酸酯酶迅速水解成更昔洛韦,发挥抗病毒作用。 药品称...


万赛维(盐酸缬更昔洛韦片)是更昔洛韦(ganciclovir)的前体药物,是一种活性更昔洛韦缬氨酸酯。它口服后可在肠道和肝脏细胞中被磷酸酯酶迅速水解成更昔洛韦,发挥抗病毒作用。
药品称呼
通用名称:Valganciclovir
商品名称:VALCYTE
英文名称:Valganciclovir
中文名称:盐酸缬更昔洛韦片
全部名称:万赛维、盐酸缬更昔洛韦片、VALCYTE、Valganciclovir
剂型和规格
1、VALCYTE片剂:450毫克、粉红色、薄膜包衣凸形椭圆形片剂,一面上刻有“VGC”,另一面刻有“450”。
2、VALCYTE口服溶液:50毫克/毫升,供应时为白色至微黄色粉末,配制后形成无色至棕黄色的什锦水果口味调味溶液。采用玻璃瓶包装,配制后可提供约100毫升溶液。
特殊人群用药
1、妊娠期
口服给药后,缬更昔洛韦(前药)转化为更昔洛韦(活性药物),因此,预计VALCYTE具有与更昔洛韦相似的生殖毒性作用。在动物研究中,更昔洛韦对怀孕小鼠和家兔造成母胎毒性和胚胎-胎儿死亡率,对家兔的致畸性是人类暴露量的两倍。尚无关于孕妇使用VALCYTE或更昔洛韦以确定是否存在药物相关风险的可用人体数据。这些人群发生重大出生缺陷和流产的背景风险尚不清楚。
体内外人体胎盘模型的数据显示,更昔洛韦可穿过人体胎盘。这种转移是通过被动扩散进行的,在1至10毫克/毫升的浓度范围内没有饱和转移。
2、哺乳期
目前尚无有关缬更昔洛韦(前药)或更昔洛韦(活性药物)在人乳中的存在、对母乳喂养婴儿的影响或对乳汁分泌的影响的数据。动物实验数据表明,更昔洛韦会从哺乳期大鼠的乳汁中排出。美国疾病控制和预防中心建议感染艾滋病毒的母亲不要用母乳喂养婴儿,以避免产后传播艾滋病毒的风险。建议哺乳期母亲在使用 VALCYTE 治疗期间不建议进行母乳喂养,因为哺乳期婴儿可能会出现严重不良事件,而且可能会传播 HIV。
3、具有生殖潜力的男性和女性
具有生育能力的女性在开始使用VALCYTE前应接受妊娠检测。
避孕:
1)女性
由于VALCYTE具有诱变和致畸潜能,因此应建议具有生育能力的女性在治疗期间和使用VALCYTE治疗后至少30天内采取有效的避孕措施。
2)男性
由于VALCYTE具有诱变潜力,建议男性在使用VALCYTE治疗期间和治疗后至少90天内使用避孕套。
不孕症:
VALCYTE 的推荐剂量可能会导致暂时性或永久性的女性和男性不孕症。
4、儿童使用
VALCYTE口服溶液和片剂适用于预防4个月至16岁的小儿肾移植患者和1个月至16岁有患CMV疾病风险的小儿心脏移植患者的CMV疾病。
在4个月至16岁的儿科肾移植患者中使用VALCYTE口服溶液和片剂预防CMV疾病是基于两项针对4个月至16岁患者的单臂、开放标签、非比较性研究。研究1是对小儿实体器官移植患者(肾脏、肝脏、心脏和肾脏/胰脏)进行的安全性和药代动力学研究。VALCYTE在移植后10天内每日给药一次,移植后最长给药100天。研究2是一项安全性和耐受性研究,在小儿肾移植患者中,VALCYTE在移植后10天内每天给药一次,最长时间为移植后200天。 这些研究的结果得到了先前在成人患者中进行的疗效展示的支持。
将VALCYTE口服溶液和片剂用于预防1个月至16岁小儿心脏移植患者的CMV疾病是基于两项研究(上述研究1和研究3),并得到了先前在成人患者中的疗效证明 。研究3是一项 VALCYTE 的药代动力学和安全性研究,研究对象是年龄小于 4 个月的小儿心脏移植患者,这些患者连续两天各接受一次 VALCYTE 口服液。根据现有的儿科和成人患者的药代动力学数据,我们建立了一个基于生理学的药代动力学(PBPK)模型,以支持年龄小于 1 个月的心脏移植患者的用药。然而,由于新生儿模型预测的不确定性,VALCYTE 不适用于该年龄组的预防。
VALCYTE口服溶液和片剂在儿童中预防 CMV 疾病的安全性和有效性尚未得到确定,包括小儿肝移植患者、小于 4 个月的肾移植患者、小于 1 个月的心脏移植患者、患有 CMV 视网膜炎的小儿艾滋病患者以及患有先天性 CMV 感染的婴儿。
5、老年用药
尚未对 65 岁以上的成人进行 VALCYTE 口服液或片剂的研究。VALCYTE 的临床研究未包括足够数量的 65 岁及以上受试者,因此无法确定他们的反应是否与年轻受试者不同。一般而言,老年患者的剂量选择应谨慎,通常应从剂量范围的低端开始,这反映了肝功能、肾功能或心功能下降以及伴随疾病或其他药物治疗的频率较高。众所周知,VALCYTE 会通过肾脏大量排泄,因此肾功能受损的患者发生毒性反应的风险可能更高。由于肾脏清除率随年龄增长而降低,因此在给药 VALCYTE 时应考虑患者的肾脏状况。应监测肾功能并相应调整剂量。
6、肾功能损害
肾功能损害患者接受VALCYTE给药时,建议减少剂量。
对于接受血液透析(CrCl 低于10毫升/分钟)的成人患者,不应使用 VALCYTE 片剂。成人血液透析患者应按照剂量减少算法使用更昔洛韦。
7、肝功能损害
尚未对肝功能受损患者服用 VALCYTE 的安全性和有效性进行研究。
禁忌症
对缬更昔洛韦、更昔洛韦或制剂的任何组分有临床意义的超敏反应(如过敏反应)的患者禁用。
药物相互作用
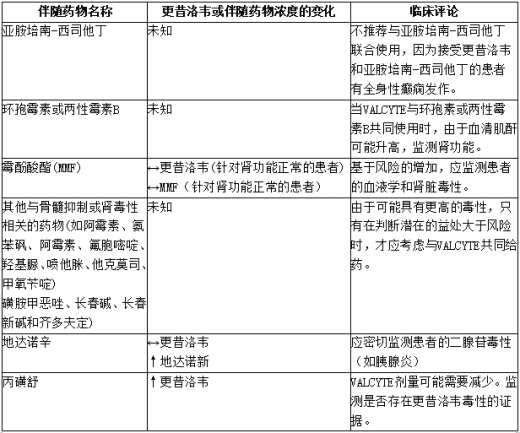
尚未使用缬更昔洛韦进行体内药物相互作用研究。然而,由于缬更昔洛韦会迅速且广泛地转化为更昔洛韦,预计缬更昔洛韦会出现与更昔洛韦相关的药物间相互作用。在肾功能正常的患者中进行了更昔洛韦的药物间相互作用研究。VALCYTE和其他经肾脏排泄的药物联合给药后,肾功能受损患者可能会出现更昔洛韦和联合给药药物浓度升高的情况。因此,应密切监测这些患者更昔洛韦和联合用药的毒性。
下表列出了更昔洛韦与已确定的和其他潜在的显著药物相互作用。
表:更昔洛韦已确定的和其他潜在的显著药物相互作用
药物过量
使用 VALCYTE 片剂的经验:过量服用 VALCYTE 可能会导致肾毒性增加。由于更昔洛韦可透析,透析可能有助于降低过量服用 VALCYTE 患者的血清浓度。应保持足够的水分。应考虑使用造血生长因子。
从临床试验和上市后经验中收到了关于过量使用缬更昔洛韦后出现不良反应的报告,其中一些不良反应导致死亡。大多数患者都出现了以下一种或多种不良反应:
血液毒性:骨髓抑制,包括全血细胞减少、骨髓衰竭、白细胞减少、中性粒细胞减少、粒细胞减少
肝毒性:肝炎,肝功能异常
肾毒性:既往有肾功能损害、急性肾损伤、肌酐升高的患者血尿恶化
胃肠道毒性:腹痛、腹泻、呕吐
神经毒性:全身性震颤、癫痫
成分
有效成分:Valganciclovir(盐酸缬更昔洛韦)
片剂的非活性成分:微晶纤维素、聚维酮 K-30、氯丙维酮和硬脂酸。片剂的薄膜涂层含有Opadry Pink。
口服溶液的非活性成分:苯甲酸钠、富马酸、聚维酮K-30、糖精钠、甘露醇和什锦水果口味调味料。
性状
片剂、口服液
贮存方法
1、将VALCYTE片剂储存在20°C至25°C的室温下。
2、将VALCYTE口服液在2°C至8°C的冰箱中储存不超过49天。
3、不要冷冻。
4、不要保存过期或不再需要的VALCYTE。
5、将VALCYTE和所有药物放在儿童拿不到的地方。
立即咨询
