Augtyro(repotrectinib,瑞普替尼)
Augtyro是一种针对ROS1致癌融合的酪氨酸激酶抑制剂(TKI),也是第二代靶向ROS1或NTRK阳性局部晚期或转移性实体瘤的新型TKI,旨在提高缓解率并延长缓解时间,并具有良好的颅内活性,是首...


Augtyro是一种针对ROS1致癌融合的酪氨酸激酶抑制剂(TKI),也是第二代靶向ROS1或NTRK阳性局部晚期或转移性实体瘤的新型TKI,旨在提高缓解率并延长缓解时间,并具有良好的颅内活性,是首款获批用于ROS1阳性NSCLC患者的新一代TKI疗法。
【规格】胶囊: 40mg,白色,不透明,速释,0号,硬壳胶囊,内装白色至类白色粉末,可能呈塞子状,盖子上印有蓝色文字 "REP 40"。
【商标】Augtyro
【通用名】repotrectinib
【中文名】瑞普替尼
【贮藏】储存温度为20℃至25℃;允许偏离15℃至30℃。
【Augtyro适应症】
Augtyro适用于治疗局部晚期或转移性ROS1阳性非小细胞肺癌(NSCLC)成年患者。
【Augtyro推荐剂量和给药方法】
一、 患者选择
根据肿瘤标本中是否存在ROS1重排,选择患者接受Augtyro治疗局部晚期或转移性NSCLC。目前尚无经FDA批准的用于检测ROS1基因重排以选择患者接受Augtyro治疗的检测方法。
二、 使用Augtyro之前的重要信息
在开始服用Augtyro之前,停用强效和中效CYP3A抑制剂3至5个半衰期。
三、 在启用Augtyro之前建议进行的评估和测试
在开始使用Augtyro之前,请进行评估:
• 肝功能检查,包括胆红素
• 尿酸水平
四、 推荐剂量
Augtyro的推荐剂量为160mg,每日口服一次,可进食或不进食,连续服用14天,然后增加至160mg,每日两次,持续服用直至疾病进展或出现不可接受的毒性反应 。
五、 针对不良反应的剂量调整
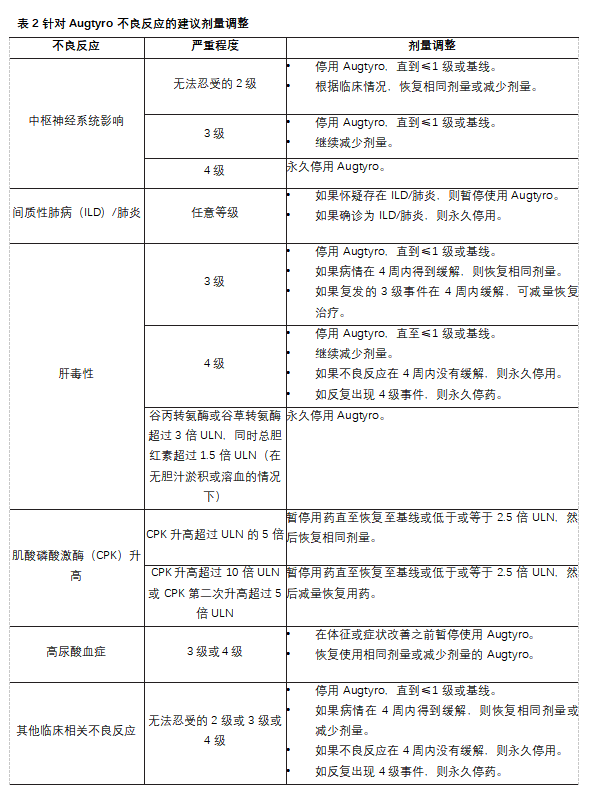
表1列出了处理不良反应时建议减少的Augtyro剂量。

表2针对Augtyro不良反应的建议剂量调整
每天大约在同一时间服用Augtyro,可进食或不进食。整粒吞服Augtyro胶囊,吞服前请勿打开、咀嚼、压碎或溶解胶囊。请勿服用任何破损、破裂或损坏的Augtyro胶囊。如果漏服Augtyro或服药后任何时候发生呕吐,请跳过该次服药,并在固定时间恢复服用Augtyro。
【Augtyro的警告和注意事项】
1. 中枢神经系统不良反应
Augtyro 可导致中枢神经系统不良反应。在TRIDENT-1研究中,351名患者接受了Augtyro治疗,其中75%的患者出现了广泛的中枢神经系统(CNS)不良反应,包括头晕、共济失调和认知障碍,4%的患者出现了3级或4级不良反应。在351例患者中,64% 的患者出现头晕(包括眩晕);2.8%的患者出现3级头晕。中位发病时间为6天(1 天至1.4年)。由于头晕,9%的患者需要中断用药,12%的患者需要减少Augtyro的剂量。351名患者中有29%出现共济失调,包括步态障碍和平衡失调;0.3%的患者出现3级共济失调。中位发病时间为15天(1 天至 1.4 年)。6%的患者需要中断剂量,8%的患者需要减少剂量,1名患者(0.3%)因共济失调永久停用了Augtyro。351名患者中有23%出现认知障碍,包括记忆力受损和注意力障碍。认知障碍包括记忆障碍(13%)、注意力障碍(11%)和混淆状态(2%);0.9%的患者出现3级认知障碍。出现认知障碍的中位时间为 37 天(1天至1.4年)。2%的患者需要中断用药,1.7%的患者需要减少剂量,0.6%的患者因认知不良反应而永久停用Augtyro。351名患者中有6%出现情绪失调。超过1%的患者出现情绪紊乱,包括焦虑(2.8%)、烦躁(1.1%)和抑郁(1.4%);0.3%的患者出现4级情绪紊乱(躁狂症)。0.3%的患者因情绪失调而需要中断用药,0.3%的患者因情绪失调而需要减少用药。351名患者中有15%出现睡眠障碍,包括失眠和过度失眠。在超过1%的患者中观察到的睡眠障碍包括嗜睡(8%)、失眠(6%)和过度失眠(1.1%)。0.9%的患者需要中断用药,0.3%的患者因睡眠障碍需要减量。观察到的中枢神经系统不良反应发生率在有和没有中枢神经系统转移的患者中相似。告知患者和护理人员使用Augtyro后出现中枢神经系统不良反应的风险。如果出现中枢神经系统不良反应,建议患者不要开车或使用机器。暂停用药,待情况好转后再以相同剂量或减量继续用药,或根据严重程度永久停用Augtyro。
2. 间质性肺病/肺炎
Augtyro可导致间质性肺病(ILD)/肺炎。在接受Augtyro治疗的351名患者中,2.9%的患者出现了 ILD/肺炎(肺炎 [2.6%] 和间质性肺病 [0.3%]);1.1%的患者出现了3级ILD/肺炎。中位发病时间为45天(19天至 0.9 年)。1.4%的患者需要中断剂量,0.6%的患者需要减少剂量,1.1%的患者因ILD/肺炎而永久停用Augtyro。监测患者是否出现表明 ILD/肺炎的新的或恶化的肺部症状。对疑似患有 ILD/肺炎的患者立即停用Augtyro,如果确诊为 ILD/肺炎,则永久停用Augtyro。
3. 肝毒性
Augtyro可导致肝中毒。在接受Augtyro治疗的351名患者中,35%的患者出现丙氨酸转氨酶(ALT)升高,40%的患者出现天门冬氨酸氨基转移酶(AST)升高,其中 2% 的患者出现 3 级或 4 级 ALT 升高,2.6% 的患者出现AST升高。出现谷丙转氨酶或谷草转氨酶升高的中位时间为15天(范围:1 天至1.9年)。分别有2.8%和1.4%的患者因ALT或AST增高而中断或减少剂量。导致剂量中断的高胆红素血症发生率为0.6%。在治疗的第一个月,每两周监测一次肝功能检测,包括谷丙转氨酶、谷草转氨酶和胆红素,此后每月监测一次,并根据临床需要进行监测。暂停治疗,病情好转后再恢复相同剂量或减少剂量,或根据严重程度永久停用Augtyro。
4. 肌痛伴肌酸磷酸激酶升高
Augtyro可引起肌痛,伴有或不伴有肌酸磷酸激酶(CPK)升高。在接受Augtyro治疗的351名患者中,13%的患者出现肌痛,其中0.6%出现3级肌痛。肌痛发生的中位时间为19天(范围:1天至 2年)。3.7%的患者在7天内同时出现CPK升高。一名患者因肌痛和CPK同时升高而中断了Augtyro的治疗。建议患者报告任何不明原因的肌肉疼痛、触痛或无力。在Augtyro治疗期间监测血清CPK水平,在治疗的第一个月每两周监测一次CPK水平,对于报告不明原因的肌肉疼痛、触痛或无力的患者,根据需要进行监测。根据临床需要启动支持性治疗。根据病情严重程度,暂停Augtyro治疗,待病情好转后再恢复相同剂量或减少剂量。
5. 高尿酸血症
Augtyro可导致高尿酸血症。在接受Augtyro治疗的351名患者中,有18名患者(5%)出现了作为不良反应报告的高尿酸血症,0.9%的患者出现了3级或4级高尿酸血症。一名没有痛风病史的患者需要服用降尿酸药物。在开始服用Augtyro之前和治疗期间定期监测血清尿酸水平。根据临床指征启动降尿酸药物治疗。暂停使用,病情好转后再恢复相同剂量或减少剂量,或根据病情严重程度永久停用Augtyro。
6. 骨折
Augtyro可导致骨折。在接受Augtyro治疗的351名成年患者中,有2.3%发生了骨折。骨折涉及肋骨(0.6%)、脚(0.6%)、脊柱(0.3%)、髋臼(0.3%)、胸骨(0.3%)和脚踝(0.3%)。一些骨折发生在疾病部位和之前接受过放射治疗的部位。骨折发生的中位时间为71 天(范围:31天至1.4年)。有0.3%的患者中断了Augtyro的治疗。及时评估有骨折迹象或症状(如疼痛、活动度改变、畸形)的患者。目前尚无数据显示Augtyro 对已知骨折愈合和未来骨折风险的影响。
7. 胚胎毒性
根据导致肌球蛋白受体酪氨酸激酶(TRK)信号变化的先天性突变的人类文献报告、动物实验结果及其作用机制,孕妇服用Augtyro可能会对胎儿造成伤害。妊娠大鼠在器官形成期口服repotrectinib会导致胎儿畸形,剂量约为根据体表面积(BSA)推荐的每日两次160mg剂量的0.3倍。告知孕妇胎儿可能面临的风险。建议具有生育能力的女性在使用Augtyro治疗期间和最后一次用药后的2个月内使用有效的非激素避孕药,因为Augtyro可使某些激素避孕药失效。建议有生育能力的女性伴侣的男性患者在使用Augtyro治疗期间和最后一次用药后的4个月内采取有效的避孕措施。
【Augtyro禁忌症】
无相关信息。
【Augtyro药物相互作用】
1、其他药物对Augtyro的影响
• 强效和中效CYP3A抑制剂
避免与强效或中效CYP3A抑制剂同时使用。Augtyro与强效或中效CYP3A抑制剂同时使用可能会增加repotrectinib的暴露量,从而增加Augtyro不良反应的发生率和严重程度。在开始服用Augtyro之前,应停用CYP3A 抑制剂3至5个消除半衰期。
• P-gp抑制剂
避免与P-gp抑制剂同时使用。Augtyro与P-gp抑制剂同时使用可能会增加repotrectinib的暴露量,这可能会增加Augtyro不良反应的发生率和严重程度。
• 强效和中效CYP3A诱导剂
避免与强效或中效CYP3A诱导剂同时使用。Augtyro与强效或中效CYP3A诱导剂同时使用可能会降低repotrectinib的血浆浓度,从而降低Augtyro的疗效。
2、 Augtyro对其他药物的影响
• 特定的CYP3A4底物
除非CYP3A底物的处方信息中另有建议,否则应避免同时使用,因为浓度的微小变化会导致药效降低。如果无法避免同时用药,请根据批准的产品标签增加CYP3A4底物的剂量。repotrectinib是一种CYP3A4诱导剂。同时使用repotrectinib会降低CYP3A4底物的浓度,从而降低这些底物的疗效。
• 避孕药
Repotrectinib是一种CYP3A4诱导剂,可减少孕激素或雌激素的暴露量,从而降低激素避孕药的疗效。避免同时使用Augtyro和激素避孕药。建议女性使用有效的非激素避孕药。
【Augtyro不良反应】
Augtyro报告的常见的不良反应包括头晕、消化不良、便秘、呼吸困难、共济失调、疲劳、认知障碍、恶心等。
【Augtyro在特殊人群中使用】
1、 妊娠
根据有关人类先天性突变导致TRK信号转导改变的文献报道、动物实验结果及其作用机理,孕妇服用Augtyro可对胎儿造成伤害。目前尚无孕妇使用Augtyro的数据。妊娠大鼠在器官形成期口服repotrectinib会导致胎儿畸形,剂量约为根据BSA计算的推荐剂量160mg的0.3倍。告知孕妇胎儿可能面临的风险。
2、 哺乳期
目前尚无关于Augtyro在人乳中的含量或其对哺乳期儿童或乳汁分泌的影响的数据。由于Augtyro可能对哺乳期儿童造成严重不良反应,建议哺乳期妇女在Augtyro治疗期间和最后一次用药后10天内停止哺乳。
3、 有生育能力的人群
给孕妇服用Augtyro可对胎儿造成伤害。在使用Augtyro之前,核实有生育能力的女性的怀孕状况。给孕妇使用Augtyro可造成胎儿损伤。建议有生育能力的女性在使用Augtyro治疗期间和最后一次服药后2个月内使用有效的非激素避孕方法。Augtyro可以使一些激素避孕药失效。根据遗传毒性发现,建议有生育能力的女性伴侣的男性患者在Augtyro治疗期间和最后一次给药后4个月内使用有效的避孕措施。
4、 儿科用药
Augtyro在ROS1阳性的小儿NSCLC患者中的安全性和有效性尚未确定。
5、 老年用药
在351例接受Augtyro治疗的患者中,21%的患者年龄在65 - 75岁之间,7%的患者年龄在75岁或以上。年龄小于65岁的患者和年龄大于65岁的患者在安全性和有效性方面没有临床意义的差异。
6、 肾损伤
对于严重肾功能损害或肾功能衰竭(eGFR-MDRD <30 mL/min)和透析患者,Augtyro的推荐剂量尚未确定。轻度或中度肾功能损害患者(eGFR-MDRD 30 ~ 90mL /min)不建议调整剂量。
7、 肝损伤
对于中度(总胆红素>1.5 ~ 3倍于正常[ULN]上限,伴有任何AST)或重度(总胆红素>3倍于正常[ULN]上限,伴有任何AST)肝功能损害的患者,Augtyro的推荐剂量尚未确定。轻度(总胆红素>1 ~ 1.5倍ULN或AST > ULN)肝功能损害患者不建议调整剂量。
立即咨询
